Analyse und Modulation von Interaktionen an artikulären Grenzflächen: Knorpelzelltransplantation
Die autologe Chondrozytentransplantation (=ACT) ist ein rekonstruktives Verfahren zur Therapie von isolierten Knorpeldefekten an Gelenkflächen (vor allem Kniegelenk und Sprunggelenk). In den Defektzonen können nach der Transplantation hyaline und hyalinähnliche Knorpelregenerate nachgewiesen werden.
Die Interaktionsmechanismen zwischen den transplantierten Chondrozyten und ihrem Umgebungsmilieu (ortsständiger Knorpel und Knochen, Periostlappen, Kollagen-Membranen, Fibrin, Synovialflüssigkeit etc.) für die "Redifferenzierung" und Regulation der Matrixproduktion sind bislang nur unzureichend geklärt.
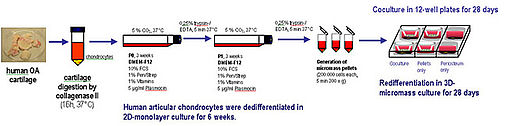
Die erstmals 1987 durch Peterson durchgeführte Transplantation autologer Chondrozyten beim Menschen stellt inzwischen ein etabliertes und anerkanntes Verfahren in der Behandlung von isolierten Knorpeldefekten dar. Nach Diagnose eines Knorpeldefekts wird intaktes Knorpelgewebe arthroskopisch aus unbelasteten Gelenkarealen gewonnen, aufgearbeitet, enzymatisch digestiert und die aus dem Gewebe gewonnen Knorpelzellen vermehrt. In vitro kommt es dabei zum Phänomen der Dedifferenzierung, d.h. die Zellen kehren in ein Proliferationstadium zurück und bilden keine hyalinspezifische Matrix mehr.
Diese "dedifferenzierten" Zellen werden dann in einer Suspensionslösung in den bearbeiteten Defekt unter ein Periostlappenkonstrukt injiziert, um dann in vivo in einer sogenannten "bioaktiven Kammer" wieder hyalinähnliches Knorpelgewebe zu bilden. Die interzellulären- und die Zell-Matrix-Interaktionen, die in dieser bioaktiven Kammer ablaufen, konnten bisher nicht näher geklärt werden.
Eine der wesentlichen Unbekannten bei der ACT stellen die für das Phänomen der De- und Redifferenzierung verantwortlichen Faktoren (Zelldichte, mechanische Einflüsse) und Modulatoren (Zytokine, Wachstumsfaktoren) dar. Sie werden entweder von den entsprechenden Zellen aus dem Gewebe (Periostzellen/Chondrozyten) selbst gebildet oder gelangen über Diffusionseffekte aus der Synovialis/Kapillaren in die bioaktive Kammer. Eine parakrine Sekretion von Wachstumsfaktoren aus dem Periostlappen wird diskutiert. Für den autologen Periostlappen wird zum einen die Funktion einer reinen biomechanischen Barriere und semipermeablen Membran postuliert, zum anderen wird ihm auf zellulärer Ebene eine direkte chondrogene Potenz und die Funktion eines Reservoirs an mesenchymalen Stammzellen zugesprochen. Bei der reinen Periost/Perichondriumtransplantation ohne Verwendung autologer Chondrozyten ist das Phänomen der enchondralen Ossifikation beschrieben worden. Die konkreten Zusammenhänge sind nicht bekannt.
Ziel
Charakterisierung der parakrinen Wechselwirkungen zwischen Periost,
sowie künstlichen Kollagenmembranen und Chondroyzten
Arbeitsprogramm
1. Kokultur von Periost / künstlicher Kollagenmembran und Chondrozyten in vitro sollen Rückschlüsse auf den Einfluss des Periosts geben. Es sollen chondrogenen Faktoren identifiziert werden, welche die Produktion eienr knorpelspezifischen Matrix begünstigen
2. Aufbauend auf diesen Ergebnissen können künstliche Kollagenmembranen mit diesen Faktoren behandelt werden.
3. Anschließend erfolgt die Untersuchung im in vivo Modell (SCID-Maus)
Durchführung
Bisher wurden drei verschiedene Versuchsserien abgeschlossen:
a) Ko-/Monokultur von mit Chondrozyten beladenen Collagen I/III Membranen mit Periost (MACI®, Fa. Verigen)
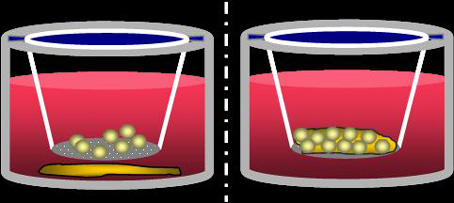
b) Ko-/Monokultur von Periost und Micromass-Pellets getrennt durch 1µm Membran, die nur parakrine Interaktion, aber keine Zell-Zell-Kontakte ermöglicht (Separatkultur), und
c) Ko-/Monokultur von Periost und Micromass-Pellets mit direktem physikalischen Kontakt (Kontaktkultur), wie er auch in vivo bei einer ACT vorliegt.
Auswertung
Der Differenzierungsstatus der Chondrozyten wurde durch quantitative PCR (qPCR) für die Gene MIA und Aggrecan analysiert. In Periost wurde die Expression von Wachstumsfaktoren (TGF-ß1), proinflammatorischen Zytokinen (IL-6), sowie von Matrix-Metalloproteinasen (MMP-2, -7, -9) durch qPCR bestimmt. Im Zellkulturüberstand wurden sezernierte Matrix-Metalloproteinasen mittels Gelatine-/ Casein-Zymographie, sezernierte Collagene per SDS-PAGE sowie Interleukin-6 per ELISA detektiert.
Ergebnisse
Es konnte gezeigt werden, dass der direkte physikalische Kontakt zwischen Periost und Chondrozyten in der Kontaktkultur zu einer erhöhten Aggrecan- und MIA Expression in den Micromass-Pellets führt. Dieser Effekt, ein Indiz für verbesserte Redifferenzierung, trat in den Separatkulturen mit ausschließlich parakriner Interaktion nicht auf. Im Zellkulturüberstand wurde aktive MMP-2 in Kokultur und Periost-Monokultur nachgewiesen, in Micromass-Monokultur jedoch nur in sehr geringer Menge. MMP-7 konnte in aktiver Form in Kokultur und Micromass-Monokultur detektiert werden, in Periost-Monokultur wird es nicht aktiviert. Das MMP-Sekretionsmuster unterschied sich zwischen Kontakt- und Separatkultur nicht. Die höchste IL-6 Expression und -Sekretion wurde an Tag 1 in Kokultur gemessen und nahm danach bis Tag 14 ab. Sezernierte Collagene wurden im Kulturüberstand der Ko- und Monokulturen wurden in ähnlichen Mengen detektiert.
Eine definitive Aussage, ob Periost die Redifferenzierung von Chondrozyten bei der ACT positiv oder negativ beeinflusst, ist auf Basis der jetzigen Datenlage noch nicht möglich.
Ausblick
In Zukunft ist geplant, TGF-ß1 sowie weitere sezernierte Differenzierungsmarker
im Zellkulturüberstand nachzuweisen (ELISA) sowie die MACI®-Kulturen auszuwerten.
Experimentelles Setup
![]()
![]()

Von links nach rechts: Knorpel aus Knie-TEP-OP
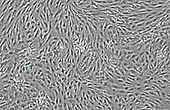
Konfluente humane Chondrozyten
Periost
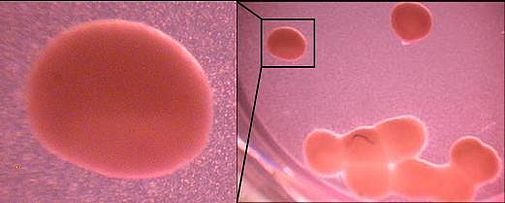
Micromass-Pellets nach 28d - Kokultur
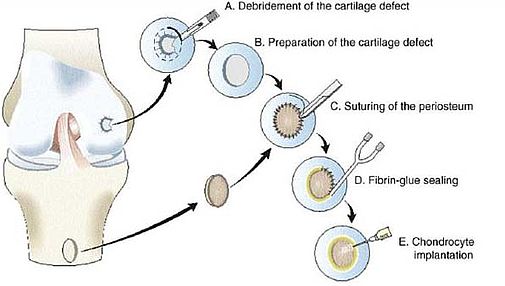
Durchführung einer autologen Chondrozytentransplantation (Marlovits et al., 2006)
Förderung
ReForM C seit 2002
1x BAT IIa/2 - Stelle
Kooperationen
PD Dr. Ulf Müller-Ladner, Klinik und Poliklinik für Innere Medizin I, Universitätsklinikum Regensburg
Dr. Radons / Prof. Falk, Klinik und Poliklinik für Innere Medizin I, Universitätsklinikum Regensburg
Prof. Dr. Anja Bosserhoff / Dr. Thomas Schubert, Molekulare Pathologie, Universitätsklinikum Regensburg
Projektrelevante Publikationen
Anders et al. (2001) Intraartikuläre operative Maßnahmen bei Arthrose. Orthopäde 30: 866-880
Brittberg et al. (1994) Treatment of deep cartilage defects in knee with autologous chondrocytes transplantation. N Engl J Med 331: 889-895
Grifka et al. (2000) Regeneration von Gelenkknorpel durch die autologe Chondrocytentransplantation. Arthroskopie 13: 113-22
Peterson et al. (2000) Two- to 9-year outcome after autologous chondrocyte transplantation of the knee. Clin Orthop 374: 212-234