Unsere Vision
Heterogenität ist eine grundlegende Eigenschaft in der Biologie. Wir streben danach, biologische Heterogenität und Diversität auf organismischer und molekularer Ebene zu identifizieren und zu beschreiben, und wir möchten verstehen, wie biologische Heterogenität die Funktion molekularer Maschinerien antreibt. Auf organismischer Ebene setzen wir uns dafür ein, unser Verständnis der mikrobiellen Vielfalt auf unserem Planeten zu erweitern. Nachdem wir in den letzten drei Jahrzehnten mehr als 1.000 Archaeenstämme aus der ganzen Welt isoliert haben, faszinieren uns besonders Organismen aus der dritten Domäne des Lebens, den Archaeen, und wir sind die Heimat des Archaea-Zentrums Regensburg. Darüber hinaus betrachten wir auch die evolutionäre Entwicklung fundamentaler biologischer Maschinerien und molekularer Prozesse, die in allen lebenden Zellen vorhanden sind. Hier konzentrieren wir uns auf Prozesse entlang des Genexpressionsweges, einschließlich der Regulation der Genexpression auf transkriptioneller (Transkriptionsfaktoren und Transkriptionsmaschinerie) und posttranskriptioneller Ebene (RNA-Prozessierung, RNA-gesteuerte Interferenz und archaeelle Sm-ähnliche Proteine) sowie auf prokaryotische Abwehrsysteme (CRISPR-Cas und prokaryotische Argonautes).
Molekulare Mechanismen von Argonaut-Proteinen
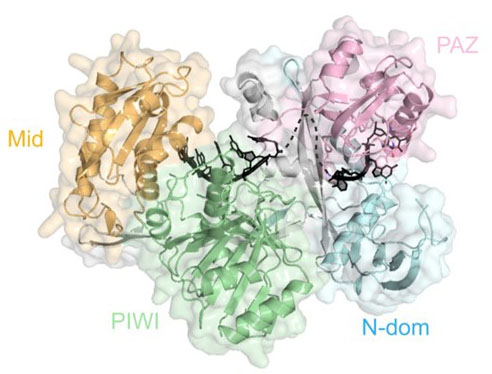
Trotz der mechanistischen und strukturellen Ähnlichkeiten zwischen archaeellen, bakteriellen und eukaryotischen Argonaut-Proteinen ist die biologische Funktion prokaryotischer Argonaut-Proteine nur unzureichend verstanden. Wir möchten die biologische Funktion prokaryotischer Argonauten aufklären. Des Weiteren interessieren wir uns besonders für die strukturellen Merkmale und das dynamische Verhalten von Argonauten, die die Substraterkennung und -spaltung fördern, um so Unterschiede und Gemeinsamkeiten in der Biologie eukaryotischer und prokaryotischer Argonauten aufzudecken.
Einzelmolekülanalyse von CRISPR-Cas-Enzymen
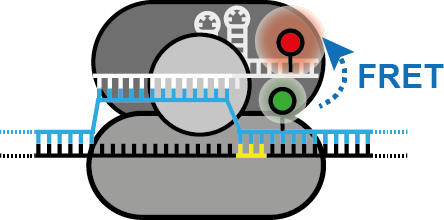
CRISPR-Cas-Systeme stellen die adaptiven Immunsysteme von Bakterien und Archaeen dar. Da wir Wissenschaftler CRISPR-Cas erst vor wenigen Jahren entdeckt haben, gibt es noch viel über die Vielfalt und Funktion dieser komplexen Abwehrsysteme zu lernen. Mithilfe biophysikalischer Techniken wie Einzelmolekül-FRET versuchen wir, die molekularen Mechanismen und die konformationelle Dynamik einer Untergruppe von Cas-Proteinen zu verstehen.
Isolierung und Charakterisierung neuer Archaeen-Spezies

Seit mehreren Jahrzehnten ist die Untersuchung mikrobieller Populationen in extremen Biotopen eines unserer Hauptforschungsgebiete. Neben der Beprobung kontinentaler und mariner Hochtemperaturbiotope (z. B. „Black Smokers“) suchen wir auch in Habitaten mit gemäßigten Temperaturen nach neuen Archaeenstämmen. Nach deren Anreicherung und Isolierung konzentrieren wir uns auf die physiologische und molekulare Charakterisierung, aber auch auf einen Ansatz zur biotechnologischen Anwendung der neuartigen Mikroorganismen. Unter anderem konzentrieren wir uns derzeit auf neuartige Konsortien aus Niedertemperaturbiotopen in Costa Rica, die aus verschiedenen archaeellen und bakteriellen Vertretern bestehen.
Charakterisierung der Ignicoccus-Nanoarchaeum-Interaktion/Symbiose
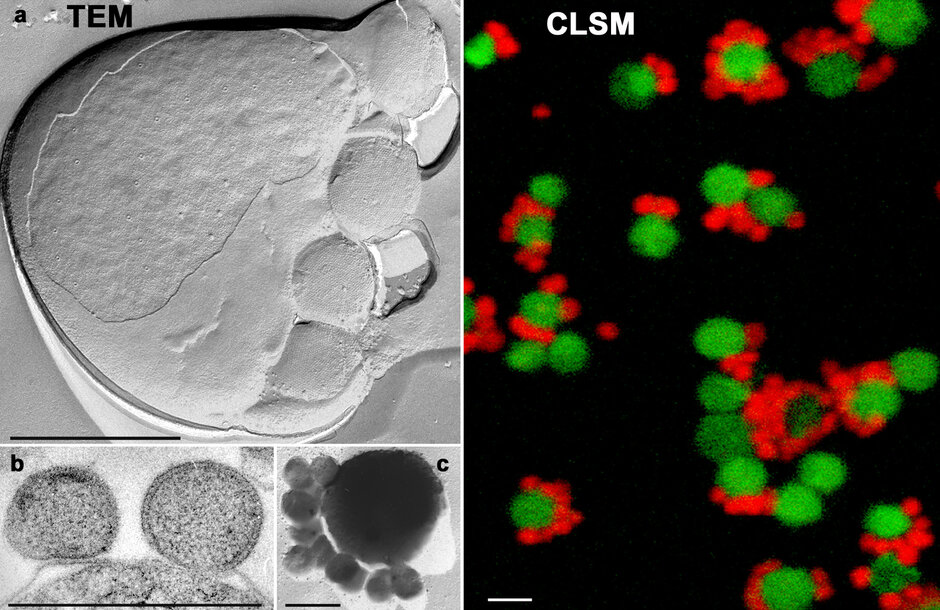
Die enge Assoziation von Ignicoccus hospitalis und Nanoarchaeum equitans ist eine mikrobielle Gemeinschaft, die ausschließlich aus Archaeen-Zellen gebildet wird. Diese faszinierende Symbiose wurde erstmals am Institut für Mikrobiologie der Universität Regensburg unter Laborbedingungen isoliert und kultiviert. Während I. hospitalis auch in Reinkultur gezüchtet werden kann, ist die Vermehrung von N. equitans-Zellen streng von einer Assoziation mit I. hospitalis-Zellen abhängig. N. equitans ist eine der kleinsten bekannten lebenden Zellen. Wir untersuchen diese faszinierende archaeelle Gemeinschaft, um Fragen zum Intermembransystem und zur Energieproduktion zu beantworten, wie N. equitans als minimalistische Zelle überleben kann.
Regulatorische Netzwerke in Archaeen
Das Genom von Pyrococcus furiosus kodiert für 85 mutmaßliche Transkriptionsfaktoren, aber die Funktion der meisten dieser Proteine und die entsprechenden genregulatorischen Netzwerke sind unbekannt. Um die Funktion einiger dieser Proteine aufzuklären, kombinieren wir traditionelle biochemische In-vitro-Techniken zur Identifizierung von Bindungssequenzen und Transkriptionsprofilen einzelner Gene mit globalen Ansätzen wie Chromatin-Immunpräzipitation und RNA-Sequenzierung, um genregulatorische Netzwerke zu rekonstruieren. Unser neuestes Projekt befasst sich mit CopR, einem Transkriptionsregulator, der notwendig ist, um bei erhöhten Kupferkonzentrationen zu überleben.
Untersuchung des archaealen Modellorganismus Pyrococcus furiosus
Pyrococcus furiosus wurde auf der Insel Vulcano in Italien isoliert und vor mehr als 30 Jahren an unserem Institut für Mikrobiologie in Regensburg beschrieben. Mit einer optimalen Wachstumstemperatur nahe dem Siedepunkt von Wasser und einer Verdopplungszeit von ~37 min dient er als Modellorganismus zur Erforschung der Biologie von Hyperthermophilen. Um eine detailliertere Funktionsanalyse zu ermöglichen, haben wir ein genetisches System etabliert, das die plasmidbasierte Expression von Proteinen sowie die markerlose Deletion einzelner Gene erlaubt. In unseren jüngsten Arbeiten liefern wir detaillierte Sequenzinformationen auf DNA- und RNA-Ebene unter Verwendung modernster Sequenzierungstechniken (Illumina-, PacBio- und Nanopore-Sequenzierung). Eine Aktualisierung auf Proteinebene mittels MALDI-TOF-Massenspektrometrieanalyse ist in Arbeit.
Nutzung methanogener Archaeen für Power-to-Gas-Anwendungen

Power-to-Gas ist ein innovatives Konzept zur Umwandlung von überschüssigem Strom aus erneuerbaren Energiequellen in Wasserstoff, entweder zur direkten Nutzung oder zur Reduktion von Kohlendioxid zu Methan. Das biologisch oder chemisch erzeugte Methan ist von besonderem Interesse, da es zur Speicherung und Verteilung in das bestehende Gasnetz eingespeist werden kann. Im Verbundprojekt „ORBIT“ wollen wir in Zusammenarbeit mit Verfahrenstechnikern, Energietechnikern und branchenführenden Industriepartnern einen Rieselbett-Reaktor für die biologische Methanisierung optimieren. Zentraler Teil des Projekts ist die Analyse verschiedener Kombinationen von methanogenen Archaeen und Reaktorkörpern, um die Methanproduktionsrate und die Methanausbeute des Prozesses zu erhöhen.
